- 上海生化与细胞所周兆才研究组与蛋白质中心黄超兰研究组合作揭示RIG-I-MAVS抗病毒信号通路调控新机制
10月18日,国际学术期刊The EMBO Journal在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所周兆才研究组与上海生科院生化与细胞所国家蛋白质科学中心•上海(筹)黄超兰研究组合作的最新研究成果——“A Non-canonical Role of the p97 Complex in RIG-I Antiviral Signaling”。该成果揭示了病毒RNA识别受体RIG-I被ATP酶p97及其复合物调控的新机制,为抗病毒治疗提供了新的潜在药物靶点。
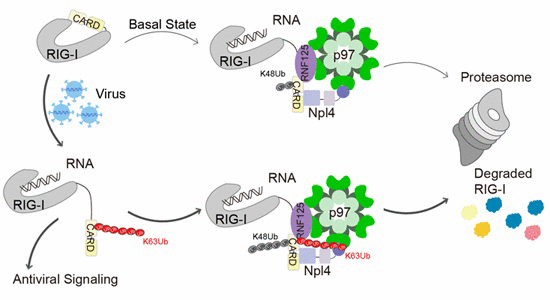
RIG-I-MAVS介导的抗病毒免疫反应在宿主对抗病原体入侵的过程中发挥重要的作用。RIG-I识别病毒RNA,发生构象变化,其CARDs结构域被释放出来,招募TRIM25等E3泛素连接酶,催化RIG-I发生K63泛素化修饰,进而与下游接头蛋白MAVS相结合,传递抗病毒信号。病毒被清除之后,RIG-I-MAVS信号通路需要及时下调或关闭,这个过程由一系列负调控因子参与完成。
ATP酶p97及其复合物在蛋白质降解调控过程中发挥重要作用,其经典功能是将泛素化修饰的底物蛋白质从复合物或亚细胞器中抽离并运送至蛋白酶体。郝茜等在周兆才研究员的指导下,发现p97复合物能够负调控RIG-I-MAVS介导的抗病毒免疫反应,抑制I型干扰素的产生。通过解析p97复合物的三维结构,并结合生化与功能研究,证实p97复合物的正确装配及ATP酶活性对其抑制抗病毒免疫反应是必需的。进一步研究发现p97复合物在此过程中发挥非经典功能,即调控底物蛋白RIG-I的K48泛素化修饰过程,并且这一调控效果依赖于RIG-I的K63泛素化修饰。黄超兰研究组以质谱手段,鉴定了p97复合物及其泛素化的底物,并验证和确定了K48该泛素化位点。
具体而言,p97复合物类似于一个“分子桥梁”,能够同时直接结合RIG-I及其E3泛素化连接酶RNF125,从而促进RIG-I第181位赖氨酸发生K48泛素化修饰。更为重要的是,病毒侵染引起的RIG-I分子构象变化使得其CARDs结构域暴露出来并发生K63泛素化,进而可以大大增强RIG-I与p97复合物之间的相互作用。这一机制保证了抗病毒反应过程中RIG-I高效激活之后,其活性将得到实时抑制。进一步动物实验表明,利用靶向p97的小分子化合物抑制其ATP酶活性,能够促进RIG-I-MAVS信号通路激活,增强小鼠抗病毒免疫反应。这些发现均提示p97复合物是一个新的抗病毒治疗的潜在药物靶点。考虑到之前已有研究表明p97可以作为一个抗肿瘤药物靶标并研发了特异性抑制剂,而且肿瘤患者在临床上往往同时需要结合抗病毒治疗,因此针对p97复合物的药物有可能具有多重功能,开发前景值得期待。
周兆才研究组以STRIPAK超分子复合物为切入点,围绕肿瘤、感染与自身免疫等重大疾病,研究免疫反应的细胞信号机制及其病态调控,为临床诊疗、药物研发提供理论依据及候选策略。部分前期研究结果已发表于Nat Immunol (Jiao et al, 2015)、Cancer Cell (Jiao et al, 2014)、Cell Res (Zhang et al, 2014; Wang et al, 2012)、Cell Rep (Song et al, 2012)、Structure (Shi et al, 2013; Zhang et al, 2013)、JBC (Chen et al, 2014; Li et al, 2014; Zhang et al, 2015; Shi et al, 2015)等。
感谢周金秋、舒红兵、蒋争凡、孙兵和王琛教授对该课题的大力支持。该项工作得到科技部、国家自然科学基金委、上海市科委以及中科院的经费资助;数据收集工作得到生化与细胞所公共技术服务中心,上海光源BL17U、国家蛋白质科学研究设施(上海)19U和质谱分析系统及北京同步辐射1W2B光束线站的支持与帮助。
 ©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017
©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017